دنیای علم و تکنولوژی
اخبار و مقالات مربوط به دنیای علم و تکنولوژی ترجمه شده از منابع معتبر
دنیای علم و تکنولوژی
اخبار و مقالات مربوط به دنیای علم و تکنولوژی ترجمه شده از منابع معتبردرباره من
دستهها
- تصاویر جالب علمی 60
- اخبار علمی 114
- تاریخ علم 21
- مقالات علمی 177
- حقایق علمی 29
- پرسش و پاسخ علمی 4
- تکنولوژی نظامی 164
- مشاهیر 8
- معرفی وبسایت علمی 10
- سخن بزرگان 4
- تفریح و سرگرمی 1
- شگفتیهای طبیعت 4
- مسابقه علمی 6
- زبان انگلیسی 18
- دیرین شناسی 32
- مهندسی مکانیک 55
- دنیای ریاضیات 48
- فایل های قابل دانلود 8
- پزشکی و سلامت 88
- ترین ها 36
- کنکور 1390 14
- نمونه سوال امتحانی و آزمون 20
- معرفی نرم افزار 4
- واژه نامههای تخصصی 1
- آزمایش های ساده و جالب فیزیک 4
- کنکور 12
- تکنولوژی نفت و حفاری 5
- بانک مقالات علمی 3
- آیرودینامیک و پرواز 6
- استانداردهای مهندسی 6
- محیط زیست 37
- باستان شناسی 5
- پروژه درسی و سمینار 5
- برنامه نویسی کامپیوتر 10
- رپرتاژ آگهی 1
ابر برجسب
ریاضیات هواپیما جنگنده موشک کنکور بمب افکن سیاهچاله جنگ جهانی دوم ستاره زمین لرزه گرمایش جهانی F-35 کووید 19 کرونا ویروسبرگهها
جدیدترین یادداشتها
همه- موشک کروز: مروری بر یکی از موثرترین سلاحهای جنگی مدرن
- ماده تاریک: راز بزرگ کیهان
- کانال جدید درخت دانش
- خورشید چه زمان می میرد؟
- جهش ژنتیکی در گرگ های چرنوبیل
- بزرگترین سیاره شناخته شده
- انسان چگونه منقرض خواهد شد؟
- تصویر سیاره مشتری از نگاه وویاجر و جیونو
- گرانش کوانتومی، تلاشی برای پیوند فیزیک کوانتومی با نسبیت عام
- ضد ماده چگونه می تواند انسان را در عرض چند سال به ستارگان دیگر ببرد؟
- سیاره شگفت انگیز COROT 7b
- آزمون واکسن جدید سرطان مبتنی بر mRNA در بریتانیا آغاز شد.
- نقش ناپلئون بناپارت در تولد دانش باستان شناسی نوین
- چهار تهدید کیهانی بزرگ برای زندگی بر روی زمین
- دایناسورها مسئول طول عمر کوتاه انسانها هستند
بایگانی
- اردیبهشت 1403 2
- فروردین 1403 2
- اسفند 1402 7
- بهمن 1402 2
- دی 1402 3
- آذر 1402 3
- آبان 1402 2
- مهر 1402 5
- شهریور 1402 4
- مرداد 1402 12
- تیر 1402 12
- خرداد 1402 5
- اردیبهشت 1402 6
- فروردین 1402 8
- اسفند 1401 6
- بهمن 1401 9
- دی 1401 2
- آذر 1401 3
- آبان 1401 1
- مهر 1401 1
- شهریور 1401 4
- مرداد 1401 7
- تیر 1401 12
- خرداد 1401 10
- اردیبهشت 1401 12
- فروردین 1401 4
- اسفند 1400 4
- بهمن 1400 7
- دی 1400 2
- آبان 1400 5
- مهر 1400 9
- شهریور 1400 1
- مرداد 1400 3
- تیر 1400 6
- خرداد 1400 7
- اردیبهشت 1400 8
- فروردین 1400 7
- اسفند 1399 12
- بهمن 1399 11
- دی 1399 1
- آذر 1399 7
- آبان 1399 2
- مهر 1399 1
- اردیبهشت 1399 7
- فروردین 1399 33
- اسفند 1398 13
- بهمن 1398 9
- دی 1398 1
- خرداد 1398 4
- اردیبهشت 1398 7
- بهمن 1397 5
- دی 1397 5
- آذر 1397 2
- آبان 1397 3
- مهر 1397 3
- شهریور 1397 1
- مرداد 1397 7
- تیر 1397 7
- خرداد 1397 2
- اردیبهشت 1397 6
- اسفند 1396 3
- بهمن 1396 5
- دی 1396 4
- آذر 1396 8
- آبان 1396 6
- مهر 1396 5
- شهریور 1396 6
- مرداد 1396 10
- تیر 1396 9
- خرداد 1396 5
- اردیبهشت 1396 3
- فروردین 1396 8
- اسفند 1395 3
- بهمن 1395 3
- دی 1395 1
- آذر 1395 4
- آبان 1395 2
- مهر 1395 7
- شهریور 1395 5
- مرداد 1395 1
- تیر 1395 3
- خرداد 1395 1
- اردیبهشت 1395 1
- فروردین 1395 3
- اسفند 1394 8
- بهمن 1394 2
- دی 1394 1
- آذر 1394 3
- آبان 1394 2
- مهر 1394 1
- مرداد 1394 1
- تیر 1394 2
- فروردین 1394 1
- اسفند 1393 4
- بهمن 1393 2
- دی 1393 1
- آبان 1393 1
- شهریور 1393 1
- مرداد 1393 1
- تیر 1393 3
- اردیبهشت 1393 7
- فروردین 1393 1
- اسفند 1392 2
- بهمن 1392 8
- دی 1392 6
- آذر 1392 16
- آبان 1392 14
- مهر 1392 19
- شهریور 1392 17
- مرداد 1392 6
- تیر 1392 2
- خرداد 1392 5
- اردیبهشت 1392 9
- فروردین 1392 1
- اسفند 1391 5
- بهمن 1391 8
- دی 1391 6
- آذر 1391 8
- آبان 1391 5
- مهر 1391 12
- شهریور 1391 7
- مرداد 1391 2
- تیر 1391 6
- خرداد 1391 7
- اردیبهشت 1391 8
- فروردین 1391 13
- اسفند 1390 7
- بهمن 1390 6
- دی 1390 11
- آذر 1390 2
- آبان 1390 6
- مهر 1390 4
- شهریور 1390 5
- مرداد 1390 8
- تیر 1390 15
- خرداد 1390 25
- اردیبهشت 1390 11
- فروردین 1390 1
- اسفند 1389 13
- بهمن 1389 12
- دی 1389 5
- آذر 1389 3
- آبان 1389 6
- مهر 1389 7
- شهریور 1389 6
- خرداد 1389 1
- اردیبهشت 1389 3
- اسفند 1388 7
- بهمن 1388 10
- دی 1388 11
- آذر 1388 7
- آبان 1388 17
- آذر 1387 1
- آبان 1387 9
- مهر 1387 5
- شهریور 1387 1
- مرداد 1387 3
- تیر 1387 7
- خرداد 1387 5
- اردیبهشت 1387 1
- فروردین 1387 3
- اسفند 1386 3
- بهمن 1386 9
- دی 1386 19
- آذر 1386 19
- آبان 1386 7
تقویم
اردیبهشت 1403| ش | ی | د | س | چ | پ | ج |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| 22 | 23 | 24 | 25 | 26 | 27 | 28 |
| 29 | 30 | 31 |
جستجو
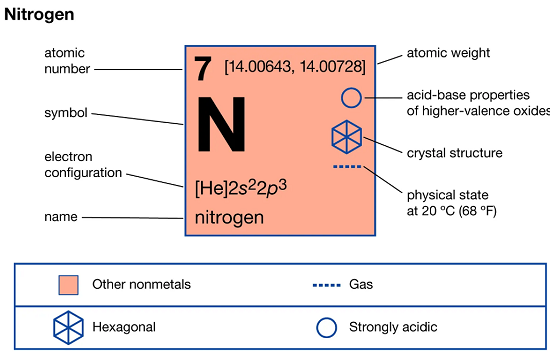
خواص عنصر نیتروژن
نیتروژن (N) که به نام ازت نیز خوانده می شود، عنصری از گروه 15 جدول تناوبی است. یک گاز بی رنگ، بی بو و بدون طعم است که در اتمسفر زمین به فراوانی یافت می شود و جزء متشکله هر ماده زنده است.
خواص عنصر |
|
|
عدد اتمی |
7 |
|
وزن اتمی |
14.0067 |
|
نقطه ذوب |
−209.86 °C (−345.8 °F) |
|
نقطه جوش |
−195.8 °C (−320.4 °F) |
|
چگالی در فشار یک اتمسفر و دمای صفر درجه سلسیوس |
1.2506 grams/litre |
|
حالت های اکسیداسیون |
−3, +3, +5 |
|
آرایش الکترونی |
1s22s22p3 |
حدود چهارپنجم اتمسفر زمین از نیتروژن تشکیل شده است. شیمیدان سوئدی کارل ویلهلم شیل در 1772 نشان داد که هوا مخلوطی از دو گاز است. یکی از آنها را به نام گاز آتش خواند که باعث احتراق می شود و دیگری گاز ناپاک (foul)، زیرا پس از مصرف تمامی گاز آتش برجای می ماند.کارهای بعدی نشان دادند که این گاز بخشی از ماده نیتر است که نامی متداول برای پتاسیوم نیترات (KNO3) بود در نتیجه توسط شیمیدان فرانسوی ژان آنتوان کلود چاپتال در 1790 نیتروژن نامیده شد. اولین کسی که پی برد نیتروژن یک عنصر است آنتوان لوران لاوازیه بود که توانسه بود نقش اکسیژن در احتراق مواد را توضیح دهد. ازت نام فرانسوی نیتروژن به معنای بدون حیات است زیرا برخلاف اکسیژن قابل تنفس نیست و نقشی در حیات ندارد.
نیتروژن از نظر فراوانی ششمین عنصر کیهانی است. اتمسفر زمین از 75.51 درصد وزنی (78.09 درصد حجمی) نیتروژن تشکیل شده است. نیتروژن آزاد در بسیاری شهابسنگ ها، در گازهای آتشفشانها، معادن و برخی چشمه های آب معدنی یافت می شود. در خورشید و برخی ستاره ها و سهابی ها نیز نیتروژن آزاد وجود دارد. 16 درصد وزن مولکولهای پروتئینی از نیتروژن ساخته شده است. در آب دریا نیز به صورت یونهای آمونیوم، نیتریت و نیترات وجود دارد.
در ابتدای قرن بیست و یکم هند، روسیه، ایالات متحده، ترینیداد و توباگو و اکراین پنج تولید کننده برتر نیتروژن به شکل آمونیا (NH3) بوده اند.
در صنعت از طریق تقطیر جزئی هوا نیتروژن بدست می آید. نقطه جوش نیتروژن 195.8- درجه سلسیوس حدود 13 درجه پایین تر از اکسیژن است در نتیجه زودتر از مخلوط هوا جدا می شود. همچنین با سوزاندن هیدروکربن ها در هوا و جدا کردن دی اکسید کربن و آب منتجه از باقیمانده احتراق می توان به نیتروژن رسید. در آزمایشگاه نیز از طریق واکنشهای زیر می توان نیتروژن خالص بدست آورد:
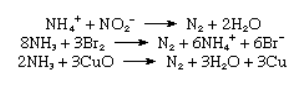
در صنعت از نیتروژن به عنوان یک گاز خنثی برای ممانعت از اکسیداسیون یا فاسد شدن محصولات، یا به عنوان بازدارنده از احتراق و انفجار استفاده می شود. به عنوان یک گاز غیرفعال برای ایجاد پلاستیک فومی (پف کرده) و برای فشرده کردن سوخت مایع جت ها استفاده می شود. در پزشکی از آن می توان برای انجماد سریع جهت نگهداشت درازمدت خون، مغز استخوان و بافت ها استفاده کرد. هم چنین در تحقیقات دماهای بسیار پایین (کرایوژنیک) از آن استفاده می شود.
نیتروژن در تایر خودرو نیز استفاده می شود زیرا می تواند تغییر در فشار داخلی تایر بواسطه تغییر دما را کاهش دهد. همچنین اندازه مولکول بزرگی دارد که باعث می شود نشت آن از تایرها دشوارتر باشد. در نیتروژن خالص رطوبت کمتری وجود دارد در نتیجه خوردگی تایر در اثر رطوبت کمتر خواهد بود. در نتیجه تایرهای پر شده با نیتروژن بطور متوسط 20 درصد عمر بیشتر از تایرهای پر شده با هوای معمولی دارند.
منابع:
https://www.britannica.com/science/nitrogen
https://www.arrivealive.mobi/nitrogen-in-tyres-and-road-safety
تدریس دروس ریاضیات دبیرستان و دانشگاه
توسط مدرس خصوصی با تجربه و دارای سابقه درخشان
ارائه جزوات مدون و نمونه تمرینهای مفصل
09360771981